今年も残すところわずかです、近隣のクリニックの先生方と月1回行っている抄読会も本日で最後です。今回の論文は”A Shifting Frame“というタイトルでした。The New England Journal of MedicineのClinical Problem-Solvingの論文です。新しい医療の発見、結果というよりは教育的な内容の論文です、珍しい症例が多く勉強になることが多いです。AI(今回はGemini 3を使用)し論文の要約を行っていきます。
1. 症例の要約
本症例は、西アフリカ(ナイジェリア)出身の32歳女性の報告です。妊娠初期のルーチン検査で無症状ながら肝酵素(AST、ALT)の上昇を指摘されました。当初は肝疾患が疑われましたが、肝生検は正常でした。その後、結核性の皮膚病変(硬結性紅斑)や好中球減少症などの併存疾患により診断が複雑化しました。最終的に、過去の「産後心筋炎」と診断された際の高クレアチンキナーゼ(CK)血症の既往と、持続する筋力低下・高CK血症が再評価され、遺伝子検査によりDuchenne型筋ジストロフィー(DMD)の保因者(有症状のジストロフィン異常症)であることが判明しました。
2. 行われた検査およびその検査結果
本症例では、診断に至るまでに多岐にわたる検査が行われました。
- 血液生化学検査:
- 肝機能: ALT 85 U/L (基準値 0-55)、AST 61 U/L (基準値 0-45) と軽度上昇が持続。ビリルビン、γ-GTP、アルカリホスファターゼ(ALP)は正常。
- 筋酵素: クレアチンキナーゼ(CK)2130 IU/L (高値)。過去(第1子出産後)に4700 U/Lという記録あり。トロポニンT 16 ng/L (基準値 <12) と軽度上昇。
- 炎症反応: CRP 1.3 mg/L、赤沈(ESR)49 mm/hr と軽度上昇。
- 血算(CBC):
- 白血球数: 2120~4020 /mm³(好中球減少あり:絶対数 800~1800 /mm³)。ヘモグロビン、血小板は正常。
- 血液型: Duffy null phenotype: Fy(a-b-)(良性の慢性好中球減少症の原因)。
- 感染症スクリーニング:
- 肝炎ウイルス(B, C, D, E)、HIV、住血吸虫:すべて陰性。
- 結核検査: IGRA(インターフェロンγ遊離試験)陽性。
- 自己免疫・リウマチ関連検査:
- 抗核抗体(ANA): 1:80(斑紋型)と低力価陽性。
- 陰性項目: 抗ミトコンドリア抗体、抗平滑筋抗体、抗LKM-1抗体、抗ENA抗体、抗dsDNA抗体、筋炎特異的抗体(抗HMGCR抗体、抗Jo-1などを含む筋炎パネル)。
- 画像検査:
- 肝臓: 腹部超音波、FibroScanともに正常。門脈圧亢進所見なし。
- 心臓MRI: 第1子産後は左室中前側壁に遅延造影あり。現在は左室中側壁に線維化を示唆する所見あり。
- 胸部CT: 上縦隔に壊死を伴うリンパ節腫大あり(結核を示唆)。
- 下肢MRI: 右内側広筋に筋肉内浮腫、外側広筋・中間広筋・大腿二頭筋に脂肪変性(萎縮)あり。
- 病理・生検検査:
- 肝生検: 正常肝組織。
- 皮膚生検(下腿結節): 小葉性脂肪織炎、肉芽腫性組織反応、静脈炎を認め、硬結性紅斑(Erythema Induratum)に合致。
- 骨髄検査: 正常細胞密度、肉芽腫なし。
- 筋生検(右内側広筋): 大部分は正常だが、孤立した壊死線維を認める。炎症細胞浸潤や肉芽腫はなし。ジストロフィン染色でモザイクパターン(染まる線維と染まらない線維の混在)を確認。
- 遺伝子検査:
- 代謝性ミオパチーのスクリーニングは陰性。
- エクソーム解析: DMD遺伝子のエクソン51-54のヘテロ接合性欠失を確認。
3. 最初に疑われた病名・最終診断・診断の根拠
- 最初に疑われた病名:
- 慢性肝疾患(ウイルス性、自己免疫性など): ALT/ASTの上昇から疑われましたが、肝生検が正常であり、他の肝酵素(ALP, γ-GTP)が正常であったことから否定されました。
- 活動性結核: 下腿の皮疹(硬結性紅斑)と縦隔リンパ節腫大、IGRA陽性から診断され、治療が行われました。しかし、筋力低下や酵素上昇の原因ではありませんでした。
- 自己免疫性筋炎: 筋力低下と高CK血症から疑われましたが、自己抗体が陰性であり、筋生検で炎症細胞浸潤が見られなかったことから否定的となりました。
- 最終診断:
- Duchenne型筋ジストロフィー(DMD)の症候性保因者(Symptomatic carrier of Duchenne Muscular Dystrophy)
- 併存症:リンパ節結核、Duffy null phenotypeによる良性好中球減少症。
- 診断の根拠:
- 高CK血症の持続: 肝由来と思われたAST/ALTの上昇は、実は筋肉由来(CK高値)であったこと。
- 筋生検の再評価: 壊死線維の存在と、ジストロフィン免疫染色での「モザイクパターン(正常な染色と欠損の混在)」の確認。これはX連鎖性遺伝疾患の女性保因者に見られる特徴的な所見です(ライオニゼーション/X染色体不活化の偏りによる)。
- 遺伝子検査: DMD遺伝子の病的欠失(エクソン51-54)が確認されたこと。
4. 患者の受けた治療、また最終経過
- 結核治療: 4剤併用療法(イソニアジド、リファンピシン、ピラジナミド、エタンブトール)などの標準治療が6ヶ月間行われ、皮疹(硬結性紅斑)とリンパ節腫大は消失しました。
- 筋症状への対応: 免疫抑制療法は行われず、経過観察となりました。結核治療後も筋力低下、肝酵素上昇、高CK血症は持続しました。
- 最終経過: 診断確定後、心臓MRIでは心筋線維化の進行、下肢MRIではミオパチーの進行が認められました。また、彼女の息子は4歳でDuchenne型筋ジストロフィーと診断されました。患者自身については、心機能のモニタリングを含む保存的な管理が継続されていると考えられます。
5. Figure(図)の解説
- Figure 1 (患者の皮疹):
- 下腿(すね)に見られる複数の有痛性の結節性紅斑の写真です。これは「硬結性紅斑(Erythema Induratum)」であり、本症例では結核に対する過敏反応として出現しました。
- Figure 2 (胸部CT):
- 造影CT画像です。上縦隔に中心部が低吸収(黒っぽく見える)のリンパ節腫大(矢印)が認められます。これは「壊死」を示唆しており、結核性リンパ節炎に典型的な所見です。
- Figure 3 (大腿部MRI):
- Panel A (T2脂肪抑制画像): 右内側広筋に高信号域(白く見える部分)があり、筋肉の浮腫(炎症や壊死)を示しています。
- Panel B (T2非脂肪抑制画像): 右外側広筋や左大腿二頭筋に高信号域が見られ、これは筋肉が脂肪に置き換わっている(脂肪変性・萎縮)ことを示唆しており、慢性の筋障害を表しています。
- Figure 4 (筋生検):
- Panel A (H&E染色): 大部分は正常な筋線維ですが、中央に1つ「壊死した筋線維」が見られます。炎症細胞の浸潤(リンパ球など)が周囲にないことが重要で、これが自己免疫性筋炎らしくない点です。
- Panel B (ジストロフィン免疫染色): 茶色く縁取られているのが正常なジストロフィンを持つ筋線維です。しかし、一部の線維では染まりが薄い、あるいは欠損しているように見えます。このように正常と欠損が混在する「モザイクパターン」は、X染色体不活化の影響を受ける女性保因者の特徴です。
6. 救命・早期診断の可能性(Retrospective Analysis)
本患者は生存していますが、「もっと早く適切な診断ができていた可能性」は非常に高かったと結論付けられています。
- 最大のポイント(Turning Point):
- 第1子出産後の「心筋炎」とされたエピソードにおいて、CKが4700 U/Lと著明に上昇していました。心筋炎でここまでの上昇は稀であり、トロポニンがあまり上がっていないこととの乖離(CK/Troponin乖離)に注目すべきでした。
- 今回、肝酵素(AST/ALT)が高いと指摘された時点で、「肝臓ではなく筋肉由来ではないか?」と考え、CKを測定していれば、肝生検という侵襲的な検査を回避できたはずです。ASTやALTは肝臓特異的ではなく、筋肉が壊れても上昇します。
- 好中球減少の解釈:
- 西アフリカ系の人々に見られるDuffy null phenotype(良性好中球減少症)を知っていれば、好中球減少を過度に病的と捉えて診断を迷走させることを防げた可能性があります。
7. 最終診断の疾患要約
Duchenne型筋ジストロフィー(DMD)保因者(Dystrophinopathy Carrier)
- 病態: DMD遺伝子(X染色体上)の変異により、筋細胞膜を裏打ちするタンパク質「ジストロフィン」が欠損・機能不全を起こす疾患です。通常は男性に発症しますが、女性は保因者となります。
- 女性保因者の症状: 多くの女性保因者は無症状ですが、X染色体の不活化(ライオニゼーション)が偏り、変異に遺伝子を持つX染色体が多く活性化されてしまうと、ジストロフィン欠損細胞の割合が増え、筋力低下や心筋症を発症します(症候性保因者)。
- リスク: 骨格筋症状だけでなく、拡張型心筋症のリスクがあり、定期的な心機能チェックが重要です。
8. ガイドラインに基づく解説
日本の「筋ジストロフィー診療ガイドライン」や国際的なケアガイドライン(DMD Care Considerations)に基づくと、以下の点が重要です。
- 保因者診断: 家系内にDMD患者がいる女性、あるいは原因不明の高CK血症や筋力低下を持つ女性に対しては、遺伝学的検査(MLPA法やシークエンス)が推奨されます。
- 心機能サーベイランス:
- DMD保因者は、無症状であっても心筋障害のリスクがあります。
- ガイドラインでは、診断時およびその後少なくとも5年ごとの心臓超音波検査や心臓MRIによる定期的なモニタリングが推奨されています。
- 遺伝カウンセリング: 次世代への遺伝リスク(男児の50%が発症、女児の50%が保因者)があるため、適切な遺伝カウンセリングが必須です。本症例でも息子さんが診断されており、早期介入(ステロイド治療など)の機会を得るためにも母親の診断は重要でした。
9. 論文のタイトルの意味
“A Shifting Frame”(移行するフレーム / ずれるフレーム)
このタイトルは、**二重の意味(Double Entendre)**が込められた秀逸なものです。
- 臨床推論の「フレーム(枠組み)」の移行:
- 最初は「肝臓の病気」というフレームで患者を見ていましたが、それが否定され、「結核(感染症)」のフレームに移り、最終的に「筋疾患(遺伝性)」というフレームに視点がシフトしていった過程を表しています。
- 遺伝子変異のメカニズム「フレームシフト(Frameshift)」:
- Duchenne型筋ジストロフィー(DMD)の原因となる遺伝子変異の多くは、欠失によって遺伝情報の読み枠がずれてしまう**「フレームシフト変異(Out-of-frame deletion)」**です(対してBecker型は読み枠が保たれるIn-frame変異)。本症例の最終診断であるDMDの分子メカニズムを暗示しています。
バーチャルカンファレンス:A Shifting Frame
タケシ教授(内科学):
「皆さん、おはようございます。本日は『肝酵素上昇』から始まり、診断が二転三転した非常に興味深い症例『A Shifting Frame』について検討会を行います。
まずは研修医のはな子先生、症例のプレゼンテーションをお願いします」
はな子先生(研修医1年目):
「はい、よろしくお願いします!
患者さんは32歳の女性、ナイジェリア出身で3年前にオーストラリアに移住された方です。
今回の来院のきっかけは、妊娠初期のスクリーニングで偶然見つかった肝酵素(AST/ALT)の上昇でした。本人は全く無症状です。
経過を段階的に説明します。
- 第1段階(肝疾患の疑い): AST 61、ALT 85という数値から、ウイルス性肝炎や自己免疫性肝炎などが疑われました。しかし、肝炎ウイルスマーカーは陰性、自己抗体も陰性、さらに肝生検まで行われましたが『正常』でした。
- 第2段階(結核の診断): その後、産後に下肢に痛みを伴う『しこり(結節)』が出現しました。皮膚生検と画像検査の結果、活動性の結核(リンパ節結核および硬結性紅斑)と診断され、抗結核薬による治療が行われました。皮疹はこれで治りました。
- 第3段階(筋疾患の疑い): 結核治療後も『筋力低下』と『肝酵素上昇』が続きました。ここでようやくCK(クレアチンキナーゼ)を測定したところ、2000以上という高値であることが判明し、肝臓ではなく筋肉の病気であることが明らかになりました」
サトシ先生(指導医):
「ありがとう、はな子先生。典型的な『診断の枠組み(Frame)』がずれていく展開だね。肝臓だと思っていたら感染症(結核)が見つかり、それを治療してもデータが治らないから、ようやく筋肉にたどり着いた、という流れだ」
はな子先生(Q1):
「はい、そこで質問なのですが、なぜもっと早く『筋肉の病気』だと気づけなかったのでしょうか? ASTやALTが上がっていれば、普通は肝臓を疑うのはわかりますが、肝生検までする前にCKを測ることはできなかったのですか?」
サトシ先生(A1):
「鋭い質問だね。実はこれがこの症例の最大のピットフォール(落とし穴)なんだ。
ASTやALTは『肝逸脱酵素』と呼ばれることが多いけれど、実際には骨格筋や心筋、赤血球にも多く含まれている。
医師は『ALT上昇=肝臓』というバイアスに陥りやすい。特にこの患者さんは無症状だったから、まずは一般的な肝疾患(脂肪肝やウイルス性肝炎)を疑ってしまったんだね。
もし初診時に、鑑別診断の一環としてCKをオーダーしていれば、肝生検という侵襲的な検査は回避できていた可能性が高いよ」
はな子先生(Q2):
「なるほど、肝酵素=肝臓と思い込まないことが大切なんですね。
もう一つ質問があります。この患者さんは3年前の第一子出産後に**『産褥期心筋炎』と診断されていますよね? 今回の最終診断である『デュシェンヌ型筋ジストロフィー(DMD)の保因者』**と、この心筋炎は関係があるのでしょうか?」
サトシ先生(A2):
「その通り、大いに関係があるよ。というか、それこそが本態だったんだ。
当時、彼女はCKが4700と異常高値だったのに、心筋トロポニン(心筋特異的なマーカー)は正常範囲だった。これは一般的な心筋炎としては非典型的だ。
DMDの保因者女性(キャリア)は、通常は無症状だけど、約10-20%程度の人に心筋症や筋力低下などの症状が出ることがあるんだ。
当時の『心筋炎』とされたエピソードは、実はジストロフィン異常による『心筋症の初発症状』であり、高CK血症もその時点で筋ジストロフィーを示唆するサインだったんだよ」
タケシ教授:
「ふむ、サトシ先生の言う通りだね。既往歴の解釈を変えることで、バラバラに見えたパズルがつながるわけだ。
ここで、病理学的な視点も重要になります。今回は特別に病理学の大河内教授にも来ていただいています。
大河内先生、今回の筋生検の所見について解説していただけますか?」
大河内教授(病理学):
「うむ、紹介に預かった大河内だ。
この症例の筋生検は非常に教育的だよ。
当初疑われた『自己免疫性筋炎』であれば、リンパ球などの炎症細胞浸潤が見られるはずだが、この検体にはそれがほとんどなかった。
代わりに見られたのは、**『孤立した壊死線維(Necrotic fiber)』**だ。
そして決定打となったのがジストロフィン染色だ。壊死していない線維ではジストロフィンが染まっていたが、遺伝子検査の結果と合わせると、彼女は『有症状保因者』であるため、正常なジストロフィンを持つ細胞と、持たない細胞が混在している(あるいは全体的に発現量が減っている)状態と考えられる。
炎症がないのに壊死がある、というのはジストロフィーを疑う重要な所見なんだよ」
タケシ教授:
「ありがとうございます。炎症がないのに壊死がある、重要ですね。
さて、議論を深めるために日本におけるこの疾患の現状についても触れておきましょう。
サトシ先生、日本ではどうかな?」
サトシ先生:
「はい。デュシェンヌ型筋ジストロフィー(DMD)は、日本でも男児の約3,500〜5,000人に1人の割合で発生すると言われており、頻度は世界と変わりません。
女性保因者については、無症状の人が多いため正確な頻度は不明ですが、本症例のように心筋症や筋症状を呈する『有症状保因者』は稀ながら確実に存在します。
診断体制についてですが、日本ではCK測定は日常的に行えますし、神経内科や小児科の専門施設であれば、筋生検やジストロフィン遺伝子(DMD遺伝子)の解析も保険診療や研究検査として実施可能です。
ただ、肝機能障害として消化器内科を受診した場合、本症例のように発見が遅れるリスクは日本でも十分にあると思います」
はな子先生:
「日本でも決して他人事ではないんですね。消化器内科に紹介されてきたとしても、CKを測るという基本を忘れないようにします」
タケシ教授:
「よし、良い議論ができたね。
今回の症例は、ナイジェリア出身という背景から結核や好中球減少(Duffy Null型)などの『ノイズ』も多かったが、本質は**『Commonな検査異常(肝酵素上昇)の裏に隠れた、Rareだが重要な疾患』**を見抜くことだった。
それでは、本日のTake Home Messageをまとめよう。
- 原因不明の肝酵素(AST/ALT)上昇を見たら、必ずCKを測定せよ。 筋肉由来の可能性を除外するまでは、肝生検に踏み切ってはいけない。
- 『既往歴』を鵜呑みにするな。 過去の診断(今回は心筋炎)が、現在の病態(筋ジストロフィー保因者)をつなぐミッシングリンクかもしれない。
- 女性でも筋ジストロフィー関連症状は出る。 DMDは男性の病気という先入観を捨て、家族歴や心筋症の合併に注意を払うこと。
以上だ。はな子先生、明日からの診療に活かしてくれたまえ」
はな子先生:
「はい! ありがとうございました!」
せっかくなのでバーチャルカンファレンスをGeminiで漫画にしてもらいました



AIの進歩は凄いですね、この症例をGeminiにポスターにしてもらうと下記のような仕上がりです。
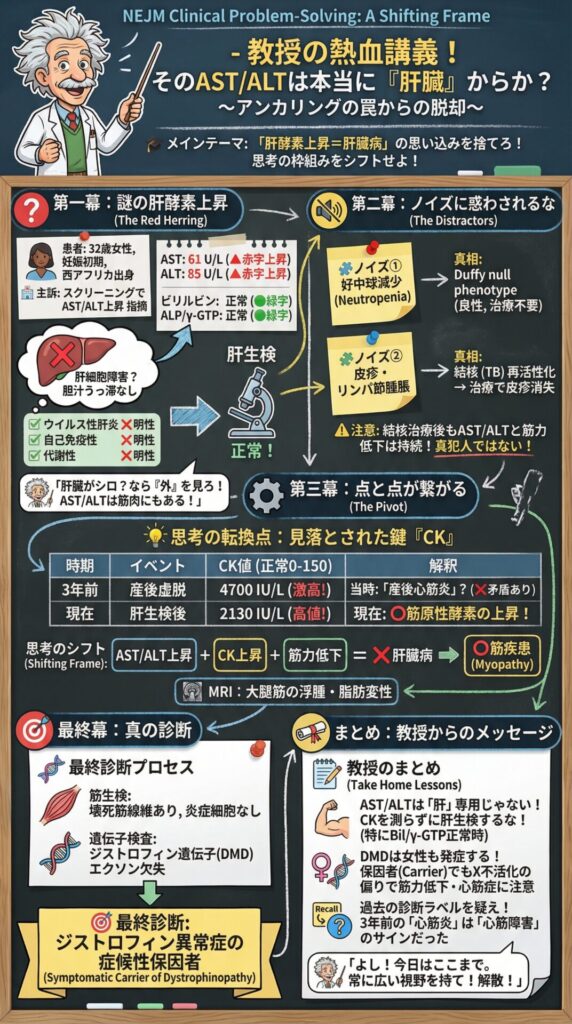
AIの賢さには驚くばかりです。AIに負けずに頑張っていきたいと思います。
最後に最近はGeminiで日々の出来事を漫画化しているのでそれも付け加えておきます。AIは人間のライバルではなくて「相棒」ですね。





コメント